La protection cathodique
... à quoi ça sert ?
La protection cathodique est une technique anticorrosion active qui élimine le risque de corrosion des ouvrages enterrés, immergés ou enrobés de béton.
La protection cathodique permet donc de pérenniser les installations, de limiter les risques de fuite donc l’impact sur l’environnement.
Un peu de théorie...
La protection cathodique consiste envoyer un courant électrique continu à un ouvrage susceptible de se corroder, qu'il soit enterré ou immergé. L'entrée du courant dans l'ouvrage à protéger permet d'abaisser son potentiel électrochimique en dessous d'une valeur donnée. Ce potentiel est défini par les normes de protection cathodique en vigueur EN 12 954 pour la majorité des cas. Ce potentiel dépend notamment de la nature du métal et du milieu dans lequel il est plongé. Dans les cas particuliers, la protection cathodique des structures complexes doit répondre aux exigences de l'EN 14 505. Les critères de protection cathodique pour les réservoirs enterrés, sous talus ou en station service, type GPL-C, sont donnés par la norme EN 13636, Protection cathodique des réservoirs métalliques enterrés et tuyauteries associées. Pour les structures en mer plusiers normes spécifiques à chaque type d'ouvrage à protéger existent (structures flottantes, installations portuaires, canalisations sous-marines,...), une norme générale est aussi éditée l'EN ISO 12473.
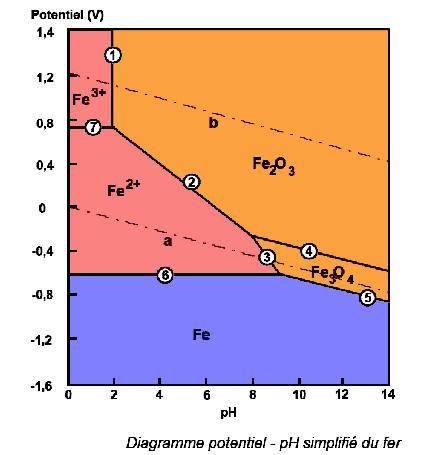
Dans le cas du fer, principal constituant de l'acier, la zone bleue représente la zone d'immunité, c'est à dire les valeurs de potentiels et de pH pour lesquels l'acier ne s'oxydera pas. La zone rose, celle dans laquelle il s'oxydera et sera stable sous forme d'ions en solution, et enfin la zone orange, l'acier forme en s'oxydant des couches d'oxydes protectrices, sa vitesse de corrosion est alors plus faible.
Lorsque le métal se corrode, deux zones distinctes se créent à l'interface avec le milieu corrosif (voir mécanisme) :
- la zone où entrent les courants, les espèces en solution se réduisent en captant les électrons fournis par l'anode, elle est appelée cathode.
Dans les cas de corrosion généralisée, ces deux zones se déplacent de façon aléatoire sur la surface du métal, la corrosion atteint toute la surface de façon uniforme. Dans le cas des corrosions localisées, ces deux zones ne se déplacent pas, la corrosion pénètre rapidement dans le métal, et le fragilise rapidement.
Deux techniques de protection cathodique sont utilisées pour fournir le courant nécessaire pour contrer les phénomènes de corrosion :
- - les anodes sacrificielles ou galvaniques : elles agissent grâce au couplage galvanique créé naturellement entre le métal de l'ouvrage et des anodes constituées de Zinc, d'alliages d'Aluminium ou de Magnésium, métaux plus électronégatifs. La différence de potentiel naturel entre les métaux crée une circulation de courant, le potentiel de l'ouvrage diminue alors que celui de l'anode augmente. L'ouvrage se trouve plus cathodique, donc se corrode moins vite que s'il était seul, voire plus du tout, et les anodes se corrodent beaucoup plus rapidement que si elles étaient seules.
- - le courant imposé : un poste de soutirage génère un courant continu qui circule entre l'ouvrage et un déversoir anodique constitué d'anodes enfouies ou immergées. Les métaux principalement utilisés sont l'acier, des alliages , du Titane recouvert d'oxydes de métaux mixtes. Elles ne sont pas forcément détruites, contrairement aux anodes sacrificielles. Le courant sort des anodes (pôle + du redresseur) et entre dans l'ouvrage (pôle - du redresseur) pour abaisser son potentiel électrochimique. Les sources d'alimentations de ce système peuvent être des postes alimentés par le réseau de distribution classique (mono ou triphasé), ou pour des puissances faibles des panneaux solaires ou des piles ou batteries degrande capacité.
* Graphique tiré du guide "Initiation à la métallurgie et à la corrosion" disponible sur le site http://www.cefracor.org/html/publications.htm
